IPTG (isopropyl-β-D-thiogalactoside) เป็นอะนาล็อกของสารตั้งต้น β-galactosidase ซึ่งสามารถเหนี่ยวนำได้สูงภายใต้การเหนี่ยวนำของ IPTG ตัวเหนี่ยวนำสามารถสร้างสารเชิงซ้อนกับโปรตีนรีเพรสเซอร์ ดังนั้นโครงสร้างของโปรตีนรีเพรสเซอร์จึงเปลี่ยนไป ดังนั้นจึงไม่สามารถรวมกับยีนเป้าหมายได้ และยีนเป้าหมายจะถูกแสดงออกอย่างมีประสิทธิภาพแล้วจะกำหนดความเข้มข้นของ IPTG ในระหว่างการทดลองได้อย่างไร?ยิ่งใหญ่กว่าก็ยิ่งดีใช่ไหม?
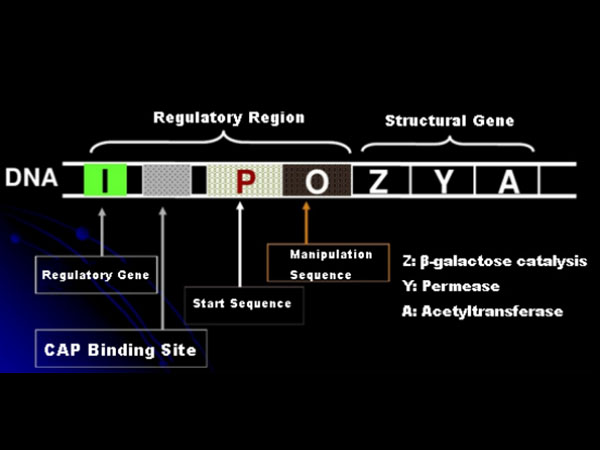
ขั้นแรก มาทำความเข้าใจหลักการของการเหนี่ยวนำ IPTG: โอเปอเรเตอร์แลคโตส (องค์ประกอบ) ของ E. coli ประกอบด้วยยีนโครงสร้างสามยีน ได้แก่ Z, Y และ A ซึ่งเข้ารหัส β-galactosidase, เพอร์มีเอส และอะซิติลทรานสเฟอเรส ตามลำดับlacZ ไฮโดรไลซ์แลคโตสเป็นกลูโคสและกาแลคโตสหรือเป็นอัลโลแลคโตสลูกไม้ช่วยให้แลคโตสในสิ่งแวดล้อมผ่านเยื่อหุ้มเซลล์และเข้าสู่เซลล์lacA ถ่ายโอนกลุ่ม acetyl จาก acetyl-CoA ไปยัง β-galactoside ซึ่งเกี่ยวข้องกับการกำจัดสารพิษนอกจากนี้ ยังมีลำดับปฏิบัติการ O ลำดับเริ่มต้น P และยีนควบคุม I รหัสยีน I คือโปรตีนรีเพรสเซอร์ที่สามารถจับกับตำแหน่ง O ของลำดับโอเปอเรเตอร์ ดังนั้นโอเปอเรเตอร์ (เมตา) จะถูกกดและ ปิด.นอกจากนี้ยังมีไซต์ที่มีผลผูกพันสำหรับไซต์ที่มีผลผูกพันโปรตีน-CAP ของตัวกระตุ้นยีน catabolic ที่ต้นน้ำของลำดับเริ่มต้น P ลำดับ P, ลำดับ O และไซต์ที่มีผลผูกพันของ CAP รวมกันเป็นขอบเขตการควบคุมของโอเปอเรเตอร์ lacการเข้ารหัสยีนของเอนไซม์ทั้งสามชนิดได้รับการควบคุมโดยขอบเขตการควบคุมเดียวกันเพื่อให้เกิดการแสดงออกที่ประสานกันของผลิตภัณฑ์ยีน
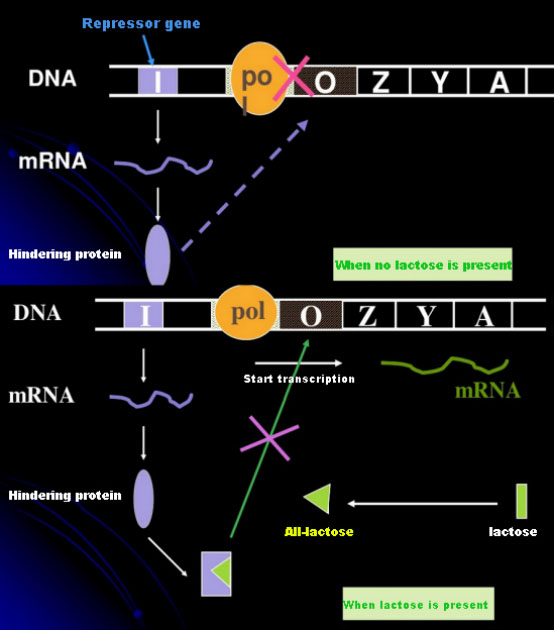
ในกรณีที่ไม่มีแลคโตส lac operon (meta) จะอยู่ในสภาวะกดขี่ในเวลานี้ ตัวอัดแรงดัน lac ที่แสดงโดยลำดับ I ภายใต้การควบคุมของลำดับโปรโมเตอร์ PI จะผูกกับลำดับ O ซึ่งป้องกัน RNA polymerase จากการจับกับลำดับ P และยับยั้งการเริ่มต้นการถอดรหัสเมื่อมีแลคโตส แลคโตส operon (เมตา) สามารถเกิดขึ้นได้ ในระบบโอเปอรอน (เมตา) นี้ ตัวเหนี่ยวนำที่แท้จริงไม่ใช่แลคโตสเองแลคโตสเข้าสู่เซลล์และถูกเร่งด้วย β-galactosidase เพื่อแปลงเป็นอัลโลแลคโตสอย่างหลังในฐานะโมเลกุลตัวเหนี่ยวนำ จับกับโปรตีนตัวอัดและเปลี่ยนแปลงโครงสร้างของโปรตีน ซึ่งนำไปสู่การแยกตัวของโปรตีนตัวกดจากลำดับ O และการถอดรหัสIsopropylthiogalactoside (IPTG) มีผลเช่นเดียวกับ allolactoseเป็นตัวเหนี่ยวนำที่ทรงพลังมาก ซึ่งไม่ถูกเผาผลาญโดยแบคทีเรียและมีความเสถียรสูง ดังนั้นจึงมีการใช้กันอย่างแพร่หลายในห้องปฏิบัติการ
จะกำหนดความเข้มข้นที่เหมาะสมของ IPTG ได้อย่างไร?ดูอีโคไลเป็นตัวอย่าง
สายพันธุ์ดัดแปลงพันธุกรรมของ E. coli BL21 ซึ่งมี pGEX ชนิดรีคอมบิแนนท์เชิงบวก (CGRP/msCT) ได้รับการปลูกเชื้อในตัวกลางของเหลว LB ที่มีแอมป์ 50μg·mL-1 และเพาะเลี้ยงข้ามคืนที่อุณหภูมิ 37°Cการเพาะเลี้ยงข้างต้นถูกเพาะเชื้อลงในอาหารเลี้ยงเชื้อ LB สดขนาด 50 มล. จำนวน 10 ขวดที่มีแอมแปร์ 50μg·mL-1 ที่อัตราส่วน 1:100 สำหรับการเพาะเลี้ยงเพื่อการขยาย และเมื่อค่า OD600 เท่ากับ 0.6~0.8 IPTG จะถูกเติมเข้าไปในความเข้มข้นสุดท้ายมันคือ 0.1, 0.2, 0.3, 0.4, 0.5, 0.6, 0.7, 0.8, 0.9, 1.0mmol·L-1หลังจากการเหนี่ยวนำที่อุณหภูมิเดียวกันและในเวลาเดียวกัน สารละลายแบคทีเรีย 1 มิลลิลิตรจะถูกดึงออกมา และเซลล์แบคทีเรียถูกรวบรวมโดยการปั่นเหวี่ยงและนำไปยัง SDS-PAGE เพื่อวิเคราะห์อิทธิพลของความเข้มข้น IPTG ที่แตกต่างกันต่อการแสดงออกของโปรตีน จากนั้น เลือกความเข้มข้นของ IPTG ที่มีการแสดงออกของโปรตีนมากที่สุด
หลังจากการทดลองจะพบว่าความเข้มข้นของ IPTG มีไม่มากเท่าที่จะเป็นไปได้เนื่องจาก IPTG มีความเป็นพิษต่อแบคทีเรียความเข้มข้นเกินจะฆ่าเซลล์ด้วยและโดยทั่วไปแล้ว เราหวังว่ายิ่งโปรตีนที่ละลายน้ำได้แสดงออกในเซลล์มากเท่าไรก็ยิ่งดีเท่านั้น แต่ในหลายกรณีที่ความเข้มข้นของ IPTG สูงเกินไป จะเกิดการรวมตัวกันจำนวนมากร่างกายแต่ปริมาณโปรตีนที่ละลายน้ำลดลงดังนั้นความเข้มข้นของ IPTG ที่เหมาะสมที่สุดมักไม่ได้ยิ่งมากเท่าไรก็ยิ่งดีเท่านั้น แต่ยิ่งความเข้มข้นต่ำลง
วัตถุประสงค์ของการชักนำและการเพาะเลี้ยงสายพันธุ์ดัดแปลงพันธุกรรมคือเพื่อเพิ่มผลผลิตของโปรตีนเป้าหมายและลดต้นทุนการแสดงออกของยีนเป้าหมายไม่เพียงได้รับผลกระทบจากปัจจัยของความเครียดและพลาสมิดในการแสดงออกเท่านั้น แต่ยังรวมถึงสภาวะภายนอกอื่นๆ ด้วย เช่น ความเข้มข้นของตัวเหนี่ยวนำ อุณหภูมิการเหนี่ยวนำ และเวลาการเหนี่ยวนำดังนั้น โดยทั่วไป ก่อนที่จะแสดงและทำให้บริสุทธิ์โปรตีนที่ไม่รู้จัก วิธีที่ดีที่สุดคือศึกษาเวลาการเหนี่ยวนำ อุณหภูมิ และความเข้มข้นของ IPTG เพื่อเลือกสภาวะที่เหมาะสมและรับผลการทดลองที่ดีที่สุด
เวลาโพสต์: Dec-31-2021

